Exploración cerebral diagnostica la enfermedad de Parkinson años antes de que se vuelva intratable
Actualizado el 26 May 2025
La enfermedad de Parkinson (EP) sigue siendo una afección difícil de tratar, sin cura conocida. Si bien las terapias han mejorado con el tiempo y la investigación en curso se centra en métodos para ralentizar o alterar la progresión de la enfermedad, el diagnóstico temprano es crucial. Detectar la enfermedad a tiempo permitiría administrar tratamientos cuando tengan el mayor potencial para preservar la función cerebral. En un estudio pionero, un equipo internacional de investigadores ha demostrado que pronto será posible diagnosticar la EP con años de antelación mediante resonancia magnética funcional (fMRI).
Desde hace tiempo se sabe que las personas que desarrollan lentamente la EP, pero que aún no presentan síntomas, a menudo experimentan una pérdida del sentido del olfato. Este deterioro sensorial puede manifestarse entre 5 y 10 años antes del inicio de los síntomas típicos de la EP, como la lentitud motora, los temblores, la rigidez y la inestabilidad postural. A pesar de esta asociación entre la pérdida del olfato y la EP, el fenómeno no ha sido ampliamente estudiado. Además, aunque muchas personas reportan una disminución en su sentido del olfato, no todas desarrollarán EP, lo que hace que este deterioro sensorial sea insuficiente como biomarcador específico.
Por otro lado, quienes se encuentran en las primeras etapas de la EP y trastornos relacionados también pueden presentar problemas visuales e incluso alucinaciones, lo que representa una vía prometedora para identificar biomarcadores más confiables. Ahora, investigadores de la Fundación Champalimaud (Lisboa, Portugal) han demostrado que la evaluación de las deficiencias olfativas y visuales en el cerebro podría proporcionar un biomarcador robusto para la detección temprana de la EP. Cuanto más temprano sea el diagnóstico, mayor será la oportunidad de un tratamiento eficaz.
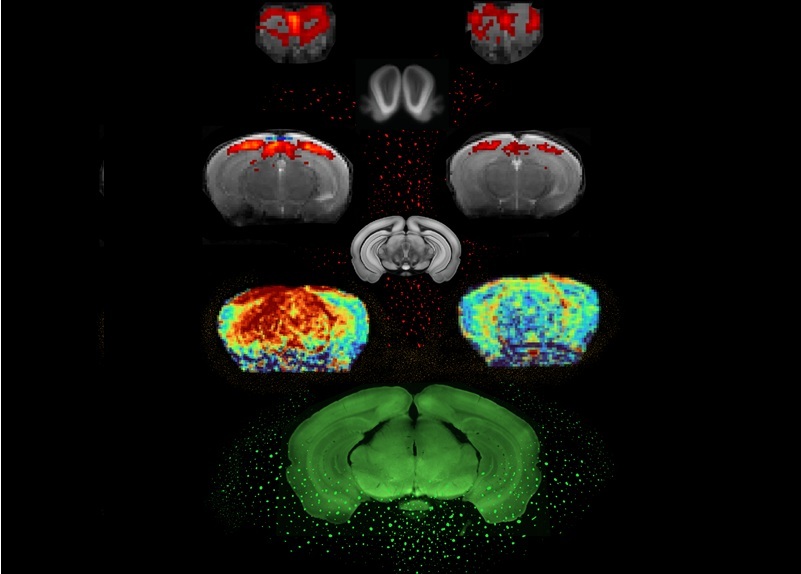
En su estudio, los investigadores utilizaron un escáner de resonancia magnética de campo ultraalto para observar un modelo murino de EP. El equipo de resonancia magnética experimental, que genera un campo magnético de 9,4 teslas (mucho más potente que los 3 teslas típicos utilizados en entornos médicos), proporcionó imágenes mejoradas, lo que permitió una vista detallada del cerebro del ratón. Los ratones transgénicos del estudio presentaban niveles elevados de alfa-sinucleína, una proteína implicada en la EP. Esta proteína se acumula y forma inclusiones en la sustancia negra, la región cerebral responsable de la producción de dopamina. La degeneración progresiva de esta área causa los síntomas motores observados en la EP.
El modelo utilizado en este estudio es valioso porque imita la acumulación de alfa-sinucleína humana y la consiguiente progresión de la enfermedad. Además, el comportamiento de estos ratones indicó un deterioro del sentido del olfato, y probablemente también experimentaron deficiencias visuales. A diferencia de los estudios típicos de fMRI en modelos animales que se centran en un solo sentido, esta investigación evaluó las modalidades sensoriales visuales y olfativas, algo poco común en los experimentos de fMRI.
La fMRI detecta la activación cerebral en respuesta a estímulos, como olores o señales visuales, mediante el seguimiento de cambios en el flujo sanguíneo y la oxigenación, los cuales reflejan la actividad neuronal. Los investigadores compararon primero los resultados de la fMRI de ratones con ovillos de alfa-sinucleína con los de sus hermanos sanos. Los ratones control mostraron una actividad cerebral normal, mientras que los ratones con EP mostraron una actividad significativamente reducida. Sin embargo, la fMRI no mide directamente la actividad neuronal; en cambio, captura una combinación de efectos neuronales y vasculares, lo que complica su interpretación. Para separar estos efectos, el equipo utilizó el mapeo del flujo sanguíneo cerebral para evaluar los cambios vasculares y descubrió que los ratones con EP presentaban una actividad vascular más débil que los controles.
Además, midieron la actividad neuronal cuantificando la proteína C-FOS, que se libera cuando se activan las neuronas. El análisis post mortem reveló una reducción más significativa de la actividad neuronal que del flujo vascular en los ratones con EP. Los investigadores concluyeron que los cambios observados en las fMRI se debieron principalmente a alteraciones en la actividad neuronal, aunque también influyeron factores vasculares y neuronales. Este estudio marca un avance significativo en la comprensión de la detección temprana de la EP, y el enfoque puede en última instancia ofrecer una forma de diagnosticar la EP años antes de que aparezcan los síntomas clínicos, lo que permitiría intervenciones más tempranas y efectivas.
“Hasta donde sabemos, esta es la primera observación de una aberración sensorial visual y olfativa combinada en la actividad cerebral de modelos de roedores con EP en general y del modelo de alfa-sinucleína en particular”, escribieron los autores en su artículo publicado en la Revista de Flujo Sanguíneo Cerebral y Metabolismo. “Esto brinda la oportunidad de que estudios futuros investiguen cómo progresan los déficits sensoriales a lo largo de la enfermedad, y quizás conduzcan al desarrollo de biomarcadores de imagen tempranos [de la enfermedad] (...)”.
Enlaces relacionados:
Fundación Champalimaud