Agrupación de proteínas puede contribuir al desarrollo de insuficiencia cardíaca
Por el equipo editorial de MedImaging en español
Actualizado el 31 May 2018
Un nuevo estudio de tomografía por emisión de positrones (TEP) revela que los oligómeros preamiloides cardíacos (PAO, por sus siglas en inglés) forman aglomeraciones en el desarrollo de la insuficiencia cardíaca (IC).Actualizado el 31 May 2018
Investigadores de la Universidad Médica de Viena (MedUni; Austria), la universidad Johns Hopkins (JHU; Baltimore, MD, EUA) y otras instituciones, realizaron un estudio para ver si la proteína mono-fosforilada desmina actúa como la semilla que nuclea las PAO encontradas en la IC humana. Para hacerlo, utilizaron un anticuerpo fluorescente y una coloración fluorescente del amiloide para visualizar y cuantificar la aglutinación de las proteínas en las biopsias de tejido cardíaco de personas con o sin insuficiencia cardíaca. Luego usaron un modelo de ratón común de IC para buscar acúmulos de desmina. El modelo implica la constricción quirúrgica de la aorta, lo que aumenta la presión arterial y el estrés.
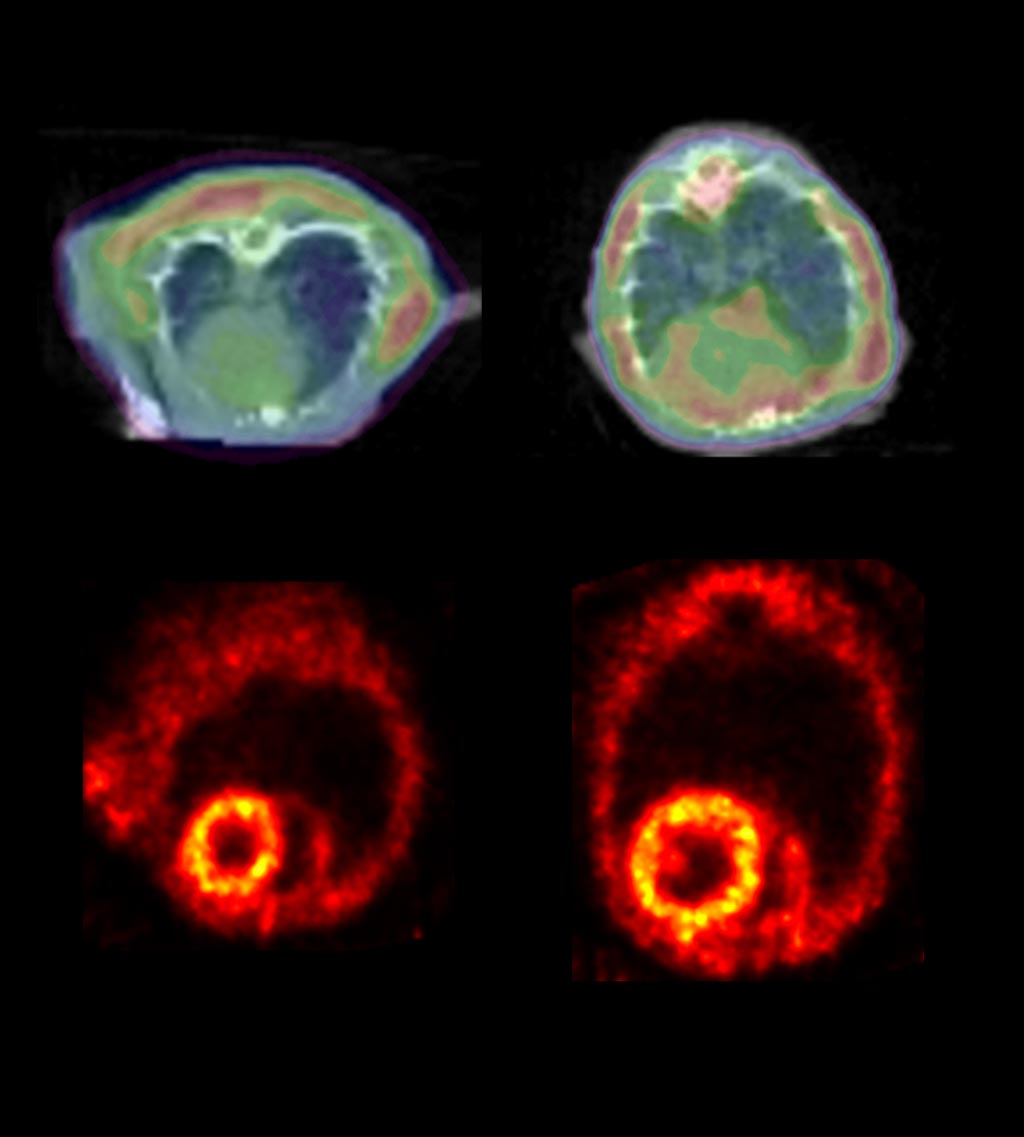
Imagen: Un examen TEP detecta la aglutinación de proteínas en la IC (D) (Fotografía cortesía de la Universidad Johns Hopkins).
Después de cuatro semanas, los ratones desarrollan síntomas de insuficiencia cardíaca, como un corazón agrandado y congestión pulmonar. Los investigadores utilizaron el colorante radioactivo, Amyvid, para obtener imágenes de los grupos de proteínas mediante TEP. Los resultados mostraron que la desmina amiloide se duplicó con creces en los ratones con IF, cuando se usó el mismo anticuerpo y las mismas técnicas de coloración utilizadas para las muestras de tejido humano. Por el contrario, cuando los investigadores utilizaron galato de epigalocatequina (EGCG) para romper el amiloide, la cantidad de grumos de proteína se redujo a la mitad. El estudio fue publicado el 11 de mayo de 2018 en la revista Circulation Research.
“Las imágenes TEP de la aglutinación de las proteínas se pueden usar eventualmente en los pacientes para identificar los cambios estructurales en el corazón a medida que avanza la enfermedad, y esta información probablemente tenga un valor pronóstico”, dijo el autor principal, Peter Rainer, MD, PhD, de la Universidad Médica de Graz. “Podría usarse como una buena medida del efecto de una intervención para detener o revertir la progresión de la enfermedad”.
“Desde un punto de vista molecular, no existe un mecanismo claro y unificado de por qué el corazón entra en falla. Pero si descubrimos este mecanismo, podremos diseñar mejores tratamientos y herramientas de diagnóstico”, dijo el autor principal, Giulio Agnetti, PhD, de la JHU. “Creo que el siguiente paso es hacer un seguimiento con las proteínas que se modifican dinámicamente en respuesta al medio ambiente, lo que pone un mayor énfasis en la intervención del estilo de vida para ayudar a prevenir las enfermedades”.










 Guided Devices.jpg)