Revelan proceso esencial del crecimiento tumoral con TEP
Por el equipo editorial de MedImaging en Español
Actualizado el 28 Apr 2008
Investigadores recientemente encontraron que los procesos metabólicos conocidos como el efecto Warburg son esenciales para el crecimiento rápido de los tumores, e identifica la forma M2 de la piruvato kinasa (PKM2; una enzima involucrada en el metabolismo de la glucosa) como un mecanismo importante detrás de este proceso. Este descubrimiento puede proporcionar un blanco para el desarrollo de las terapias futuras para el cáncer.Actualizado el 28 Apr 2008
Hace cerca de 80 años, científicos observaron que las células cancerosas realizan el metabolismo de energía de una manera diferente al de las células adultas normales. Muchas décadas después, esta observación fue explotada por los médicos para visualizar mejor los tumores usando tecnología de tomografía de emisión de positrones (TEP). Pero no se conocía de manera precisa cómo las células tumorales realizan esta tarea metabólica alterna, ni tampoco se sabía si este proceso era fundamental para el crecimiento del tumor.
Ahora, dos estudios publicados en la edición del 13 de marzo de 2008 de la revista Nature pueden ayudar a responder esas preguntas. El estudio fue realizado por investigadores del Centro Médico Beth Israel Deaconess (BIDMC; Boston, MA, EUA; www.bidmc.harvard.edu) y la escuela Médica Harvard (Cambridge, MA, EUA; www.hms.harvard.edu). "Con este estudio hemos respondido una pregunta fundamental con relación a la capacidad de las células tumorales para crecer y proliferar rápidamente”, explicó el autor principal Lewis Cantley, Ph.D., director del Centro de Cáncer en BIDMC y profesor de biología de sistemas de la Escuela Médica Harvard.
La regulación metabólica en tejidos que crecen rápidamente, tales como el tejido fetal o los tumores, es diferente del de un tejido adulto normal, explicó el Dr. Cantley. "A través de la glicólisis aeróbica, o el efecto Warburg, las células cancerosas producen energía captando glucosa a tasas mucho más altas que otras células mientras, que al mismo tiempo, usan una fracción más pequeña de glucosa para la producción de energía. Esto le permite a las células cancerosas funcionar como las células fetales, promoviendo el crecimiento extremadamente rápido”.
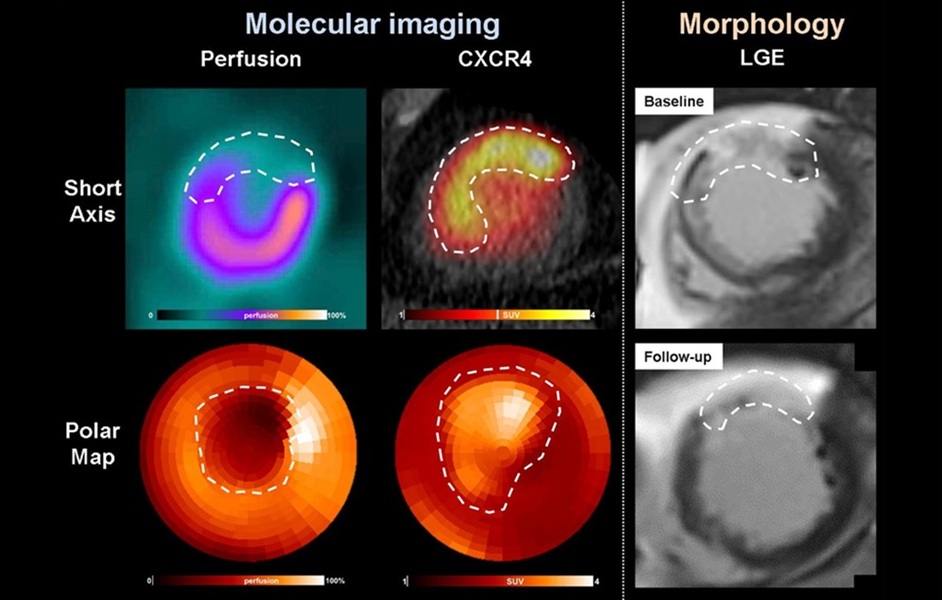
Esta característica metabólica distintiva de las células cancerosas ha llevado a la efectividad de la TEP como un medio de detección del cáncer porque la glucosa radioactiva inyectada en los pacientes antes del examen de imagenología es captada preferencialmente por las células tumorales ávidas de glucosa, las regiones de alta captación de glucosa son mostradas significativamente en la TEP.
Usando una pantalla proteómica novedosa para identificar proteínas nuevas ligantes de fosfotirosina, el Dr. Cantley y colegas determinaron primero que la PKM2 puede unirse a péptidos que contienen fosfotirosina. "Observamos que en contraste a las formas de piruvato kinasa encontradas en la mayoría de los tejidos adultos normales, solo PKM2, que se encuentra en las células fetales, interactuó con la fosfotirosina”, explicó el Dr. Cantley.
Para entender las implicaciones de este descubrimiento, los investigadores se embarcaron en experimentos para evaluar la importancia de PKM2 para las células cancerosas. Considerando que el tejido tumoral cambia la expresión de la piruvato kinasa de una isoforma M1 adulta a la isoforma M2 embrionaria, realizaron análisis de inmunoblot e inmunohistoquímica de numerosas líneas celulares cancerosas, modelos de cáncer de seno y cáncer de colon humano, confirmando que PKM2 fue la única forma de piruvato kinasa encontrada en el tejido canceroso.
Los hallazgos son consistentes con la hipótesis de que las células tumorales preferencialmente usan glucosa para propósitos diferentes de los de la adenosina trifosfato (ATP), usada para la transferencia de energía.